レプチン受容体 FnIII ドメインバリアントがドメイン配向を崩し回転や屈曲を引き起こす
2025年02月07日患者・一般
発表のポイント
- レプチン受容体のFnIII ドメインに生じる複数のミスセンスバリアントが、肥満関連シグナル(JAK-STAT3 経路)に重要なFnIII-2~3ドメイン構造の不安定化を引き起こすことを発見
- 分子動力学シミュレーションによる 300 ns スケールの解析を通じて、従来の実験系では捉えにくいドメインの折れ曲がりや回転などの動的変化を捉えた
- ジスルフィド結合破綻やフォールディング核のバリアントが特に深刻な機能低下を招くことから、抗肥満治療標的となりうる可能性がある
研究概要
東京大学医学部附属病院 糖尿病・代謝内科の加藤貴史特任臨床医、庄嶋伸浩准教授、山内敏正教授らによる研究グループは、レプチン受容体(LEPR(注1))細胞外領域に存在する Fibronectin Type III(FnIII)ドメイン(注2)のミスセンスバリアントが、どのようにシグナル伝達を担う三次元構造を破綻させるかを解明しました。本研究では、10 種類の疾患原因バリアントと 2 種類の対照バリアントを対象に、分子動力学シミュレーション(注3)やフォールディング核(注4)解析を組み合わせて詳細に評価し、特にインタードメイン剛直性の低下とドメイン内部の疎水コア崩壊がシグナル伝達障害に重要なFnIIIドメインの不安定化に直結することを初めて示しました。
本成果により、LEPR バリアントに起因する重度肥満の分子機序が明確化されただけでなく、ミスセンスバリアントの発生部位ごとに異なる立体障害の特性が明らかとなりました。これらの知見は、ドメイン間の配向制御やフォールディング核の安定化をターゲットとする新たな抗肥満治療戦略の基盤となることが期待されます。本研究成果は、2024年11月27日(現地時間)に国際学術誌「journal of molecular graphics and modeling」にオンライン掲載されました。
研究内容
1.研究の背景
レプチン受容体(LEPR)は脂肪細胞から分泌されるホルモン「レプチン」と結合し、食欲やエネルギー代謝を制御する重要な膜タンパク質です。LEPR が機能不全となると、過食や病的肥満を引き起こし、糖尿病や心血管疾患をはじめとする多くの肥満合併症リスクが高まります。近年の細胞実験により、細胞外領域の一部である FnIII ドメインに変異が発生すると、ヤヌスキナーゼ(JAK)-STAT3 経路の活性化が損なわれることが報告されました。しかし、単にアミノ酸配列が変化するだけでなく、三次元構造がどのように乱れ、どの部位が特に致命的な障害を受けるのかは十分に解明されていませんでした。
一方、最近の 分子動力学(MD)シミュレーション の進歩により、単一アミノ酸変異でも大規模な受容体タンパク質の動的構造変化を長時間スケールで観察できるようになりました。本研究では、この MD シミュレーションを中心に、フォールディング核(折り畳みの要)解析やバイオインフォマティクスツール(FoldX など)と併用することで、LEPR-FnIII ドメインバリアントの重度肥満発症メカニズムを包括的に把握しようと試みました。
2.研究の内容
1.バリアントの選定と 3D 構造モデルの作製
ヒト LEPR 遺伝子変異情報をもつデータベースから、FnIII-2 および FnIII-3 ドメインに位置する疾患原因バリアントを抽出。AlphaFold2 の予測モデルを基にミスセンスバリアントの導入構造を作成しました。
2.MD シミュレーションとフォールディング核解析
- 300 ns の長時間 MD を実施し、RMSD(ルート平均二乗偏差)や RMSF(原子ごとの振動幅)を用いてドメイン間・ドメイン内部のゆらぎを定量化。
- フォールディング核と呼ばれる疎水性コアのアミノ酸の特定を行い、各バリアントがこの核や接触層を置換することで折り畳み障害を引き起こすかを評価。
3.主な発見
- ジスルフィド結合(注5)破綻型バリアント(C604S/G)は、FnIII-2 & 3 ドメイン間の剛直性を一気に失わせ、両ドメインの大きな回転やずれを誘発。
- フォールディング核を直接破壊するバリアント(L662S, W664R など)は、疎水性コアの空隙化や水素結合の破綻を引き起こし、ドメイン折り畳みを阻害。
- バリアントの部位によっては、FoldX 解析上ではさほど高いエネルギー変化(ddG 値)を示さずとも、MD では著しいインタードメイン配向の乱れを可視化する例(P639L, W646C, N718S)があり、熱力学的指標だけでは予測しきれない病態形成が存在することを示唆。
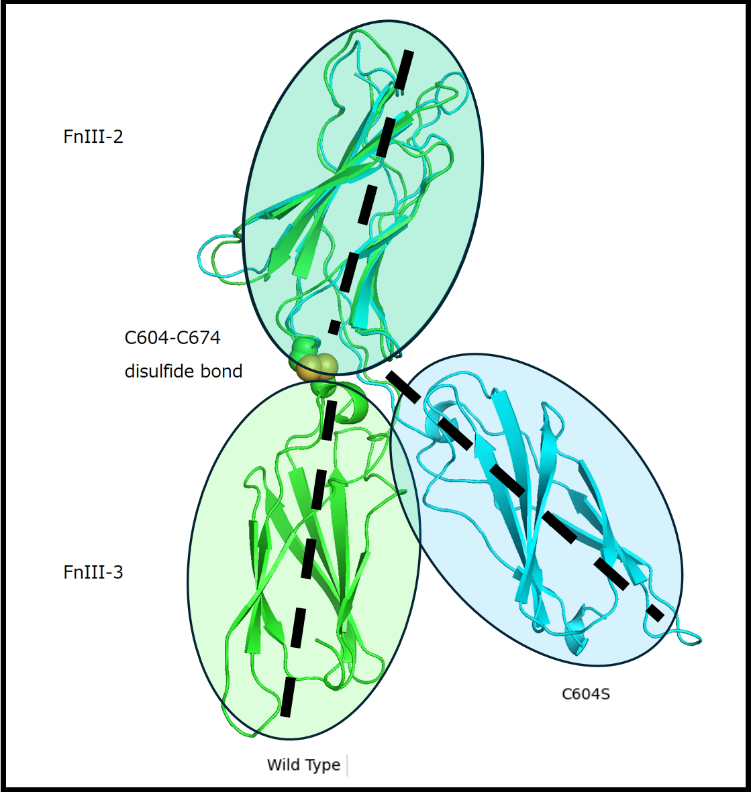
図:野生型とC604Sバリアントのドメイン屈曲の様子
300 nsのMDシミュレーションによってC604-C674に存在するジスルフィド結合消失の影響を捉えた。野生型のFnIII-2とFnIII-3の直線的な配向がC604Sでは屈曲し破綻していた。
3.今後の展望
本研究の成果によりLEPR-FnIII ドメインに生じたミスセンスバリアントが立体構造をどのように壊しLEPR機能不全を招くかを示しました。特に次のような臨床応用が考えられます。
1.ドメイン間配向を補正する低分子化合物の探索
MD シミュレーションで観察された「インタードメインねじれ」を抑制する分子を in silico スクリーニングすることで、LEPR疾患患者に対する治療法の開発につながる可能性があります。
2.バイオインフォマティクスツールの高精度化
FoldX(注6)などで過小評価されがちなインタードメイン効果を補完するため、MD シミュレーションや機械学習手法を統合した予測モデルの確立が期待されます。
論文情報
雑誌名
Journal of Molecular Graphics and Modelling
論文タイトル
Pathogenic variants in the fibronectin type III domain of leptin receptor: Molecular dynamics simulation and structural analysis
著者
加藤 貴史、松澤 史子、庄嶋 伸浩、山内 敏正*
DOI
10.1016/j.jmgm.2024.108912
掲載日
2024年11月27日(オンライン)
研究者
加藤 貴史(東京大学医学部附属病院 糖尿病・代謝内科 特任臨床医)
共同研究機関
株式会社アルティフ・ラボラトリーズ(Altif Laboratories Inc.)
用語解説
(注1)レプチン受容体(LEPR):
脂肪細胞由来ホルモン「レプチン」に結合し、食欲抑制やエネルギー恒常性維持を担う膜タンパク質。ミスセンスバリアントなどにより重度肥満や過食を引き起こすことが多数報告されている。
(注2)Fibronectin Type III(FnIII)ドメイン:
多くの細胞外受容体や細胞接着分子に含まれる折り畳みモチーフ。複数連結することで立体構造の安定化やシグナル伝達に寄与する。LEPRではシグナル伝達に必須の構造となっている。
(注3)分子動力学(MD)シミュレーション:
コンピューター上で原子の動きを仮想的に動かし、短時間スケール(フェムト秒〜ナノ秒)ごとの原子位置や相互作用を計算する実験手法。
(注4)フォールディング核(folding nucleus):
タンパク質折り畳みの初期段階で安定な疎水性コアを形成する重要アミノ酸残基群。ここに置換(ミスセンスバリアント)が発生するとミスフォールディングを引き起こしやすい。
(注5)ジスルフィド結合:
システイン残基同士が -S-S- 結合を形成し、分子内・分子間の構造安定性を高める。FnIII-2 と FnIII-3 をつなぐ C604–C674 結合は LEPR 機能維持に重要。
(注6)FoldX:
ミスセンスバリアントによるタンパク質安定性の低下を予測するバイオインフォマティクスツール。ドメイン内部の熱力学的安定性解析が主目的。