脂質代謝に関わる筋萎縮性側索硬化症(ALS)の新規原因遺伝子を発見
2024年02月16日患者・一般
発表のポイント
- 筋萎縮性側索硬化症(ALS)および前頭側頭型認知症(FTD)の原因遺伝子として、脂質代謝に重要なSPTLC2遺伝子を同定しました。
- 脂質分析により、同遺伝子の変異を有する患者血漿において、スフィンゴ脂質の合成が亢進していることを明らかにしました。
- 特定の脂質代謝異常を是正することによりALSの治療が可能になることが期待されます。
研究概要
この度、東京大学大学院医学系研究科の戸田達史教授、成瀬紘也特任助教らの研究グループは、脂質代謝に関わる筋萎縮性側索硬化症(ALS)の新規原因遺伝子の同定に成功しました。
筋萎縮性側索硬化症(ALS)は、運動ニューロンの選択的細胞死により運動機能が失われ、3年から5年で死に至る代表的な神経難病です。その病態は十分に解明されておらず現時点で根治療法は見出されていません。本研究では典型的には55-75歳で発症するALS症例に対して、40歳未満で発症する若年発症のALSの複数家系に着目し、網羅的ゲノム解析情報などを駆使して、ALSの病態解明を進めました。その結果、若年発症のALSに前頭側頭型認知症(FTD)を合併する複数家系において、スフィンゴ脂質(注1)の代謝に重要な役割をもつSPTLC2遺伝子の病原性変異を初めて同定しました。さらに詳細な脂質分析(注2)によって、SPTLC2遺伝子の変異を有する患者血漿において、セラミドなどのスフィンゴ脂質の合成が亢進していることを明らかにしました。これらの発見は、SPTLC2遺伝子が若年発症のALSおよびFTDの新規原因遺伝子であること、変異によるスフィンゴ脂質の代謝異常がALSおよびFTDの病態に寄与することを示しています。さらに今回脂質代謝の障害とALS発症を関連付ける病態メカニズムを遺伝学的に解明したことにより、特定の脂質代謝異常を是正することが新たなALSの治療の選択肢となり、今後の治療法の開発にもつながることが期待されます。
研究内容
1.研究の背景
筋萎縮性側索硬化症(amyotrophic lateral sclerosis: ALS)は、上位および下位の運動ニューロン(筋肉を動かし、運動をつかさどる神経)の選択的な変性・脱落から、進行性に全身の筋力低下をきたす、成人発症の神経変性疾患です。その進行は早く、典型的な症例では発症から3年から5年で呼吸不全から死亡または人工呼吸器装着が必要となります。病態にはまだ不明な点が多く、根治療法が見出されていない代表的な神経難病の一つです。一般にALSの5–10%は家族歴のある家族性ALSとされていますが、残りの大多数は家族歴のない孤発性ALSと考えられています。ALSは典型的には55-75歳時に発症しますが、40歳未満で発症する若年発症のALSも知られており、多彩な臨床病型を呈することも報告されています。
ALSの遺伝的病因の解明は、運動ニューロン変性の病態基盤の理解を深め、疾患モデルの作成や治療法の研究につながってきました。近年の次世代シーケンサー(注3)による遺伝子解析能力の向上により、現在までに40以上のALS関連遺伝子が同定されています。我々は網羅的ゲノム解析情報を活用して、日本人ALSのゲノム基盤の解明を進め、2022年度時点で家族性ALSの約59%、孤発性ALSの約4%の症例で、病原性変異を同定しました(参考1、2)。その一方で病原性変異が見つからないALS症例も相当数存在するのが現状です。ALSの新規原因遺伝子の同定は、発症機序を解明し、現在根治療法が確立していないALSに対する病態に応じた治療法を開発するためにも、喫緊かつ重要な課題でした。
2.研究成果
本研究で我々は、若年発症のALS家系に着目し、親子トリオ解析を含む網羅的ゲノム解析、タンパク質の構造解析、スフィンゴ脂質を対象とした詳細な脂質分析を駆使してALSの病態解明を進めました。まず若年発症の家族性ALSの家系に注目し、発症者および非発症者を対象に全エクソンを読むエクソーム解析を実施し、発症者のみに検出され非発症者や健常者データベースに登録がなく、機能予測から病原性と考えられる変異を探索しました。その結果、スフィンゴ脂質生合成経路のkey enzymeであるセリンパルミトイル転移酵素(serine palmitoyltransferase: SPT)をコードするSPTLC2(serine palmitoyltransferase long chain base subunit 2)遺伝子の新規変異(p.Ala71Val)を同定しました(家系1)。さらに若年発症の孤発性ALS症例について、発症者および非発症の両親のエクソーム解析データに基づくトリオ解析を実施したところ、新生突然(de novo)変異(注4)としてSPTLC2遺伝子の新規変異(p.Met68Arg)を検出しました(家系2;図1)。
SPTLC2遺伝子の変異は従来、遺伝性感覚性自律神経性ニューロパチー(hereditary sensory and autonomic neuropathy: HSAN)の原因になることが報告されていました(参考3)。HSANは主に感覚神経が障害される疾患であり、ALSとはその臨床像が大きく異なります。ALSおよびHSANを引き起こすSPTLC2遺伝子の変異の部位を比較すると、我々が同定したALS症例の変異は膜関連領域に位置していました(図1)。SPTLC2はSPTLC1およびssSPT(serine palmitoyltransferase small subunit)とともに、SPT複合体を形成します。クライオ電子顕微鏡法(cryo-EM)に基づくSPT複合体の構造解析から、今回のSPTLC2遺伝子の新規変異は、ORMDL3というSPTの活性を調節するサブユニットに隣接した膜関連領域に位置することがわかりました(図2)。同様にSPT複合体を構成するSPTLC1のORMDL3に近接した部位の変異が、若年発症のALSの原因になることが最近報告されており(参考4、5)、今回のSPTLC2遺伝子の新規変異との、SPT複合体内における局在の類似性を認めました。SPTLC2のORMDL3に隣接する部位の変異がORMDL3によるSPTの活性を制御する機能を障害し、SPTの活性亢進によりスフィンゴ脂質の過剰産生に至る機序が考えられました(図3)。
そこで我々は、SPTLC2遺伝子変異を持つALS患者における、スフィンゴ脂質の合成亢進の有無を検討しました。同一家系内で変異を有するALS発症者と、変異を有しない非発症者から血漿検体を採取し、脂質分析を実施しました。その結果、変異を有する発症者群において、血漿中のスフィンガニンやセラミドの有意な増加が観察されました(図4)。これはSPTの活性亢進によるスフィンゴ脂質の産生増加を反映したものと考えられました。
興味深いことに、今回同定したSPTLC2遺伝子変異を有する若年発症のALSの全症例で、FTDを示唆する認知機能低下を認めていました。変異による脂質代謝異常が、若年発症のALSのみならずFTDなどのより幅広い臨床症状に寄与する可能性があります。
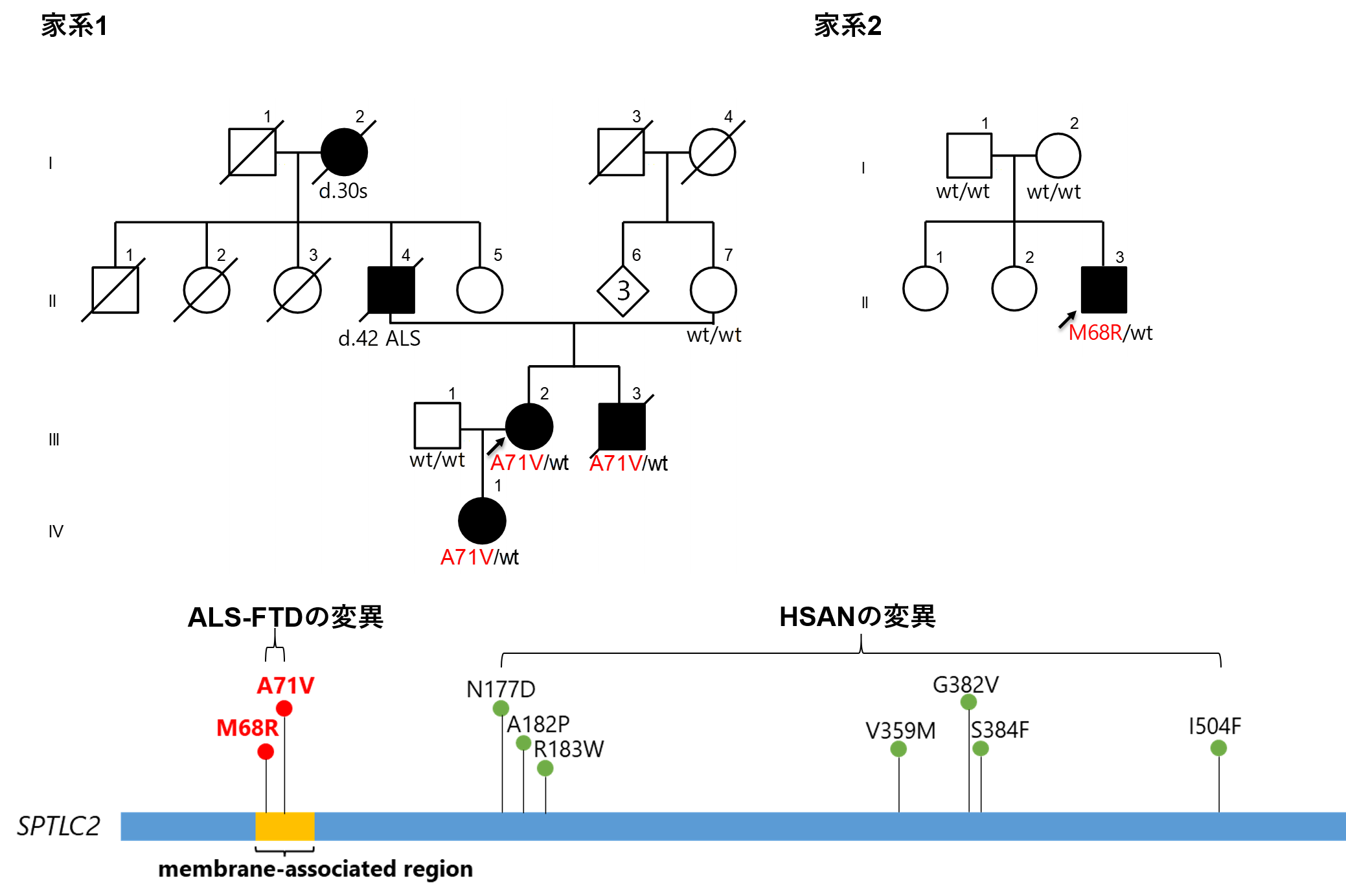
図1:若年発症のALSの2家系に検出されたSPTLC2遺伝子の変異とその部位
今回同定したALS-FTDの原因変異は膜関連領域に位置するのに対して、HSANの原因変異はそれ以外の部位に位置しています。
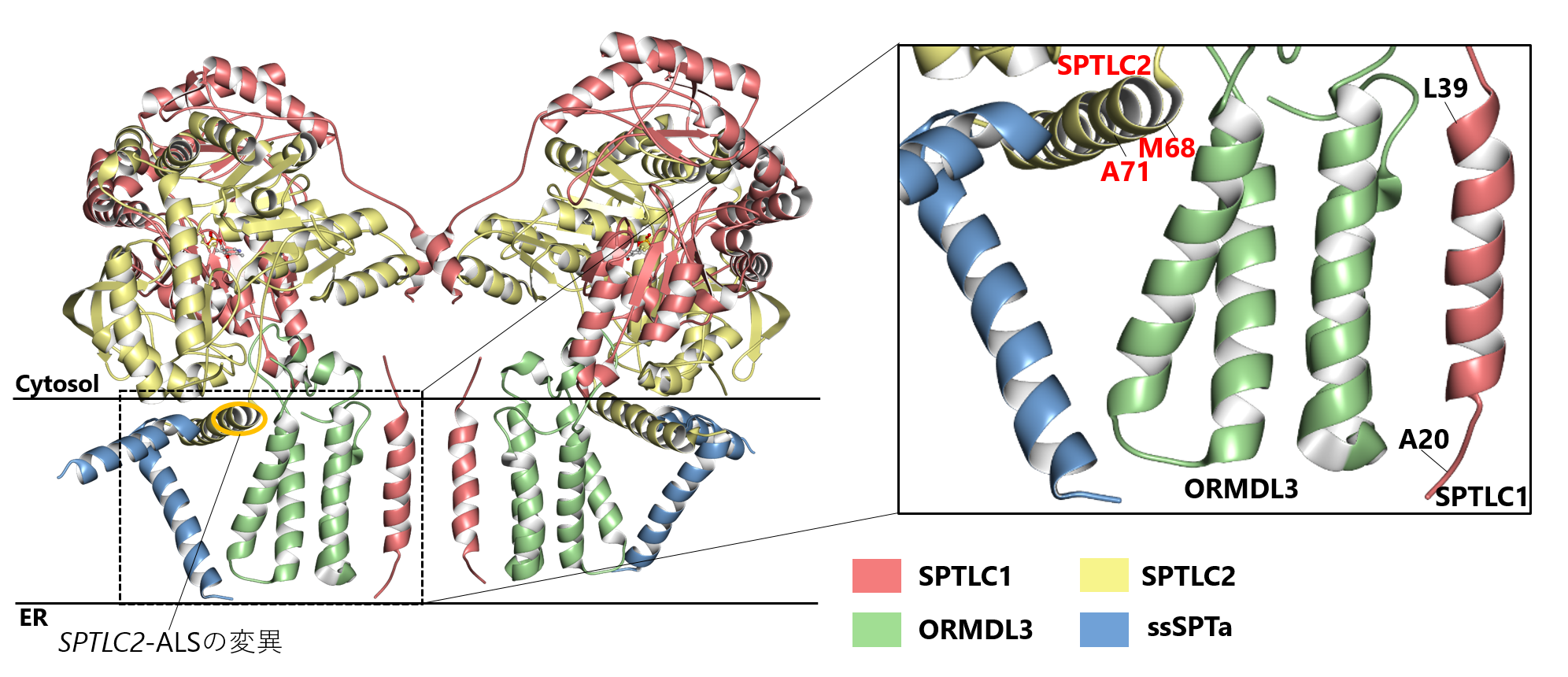
図2:Cryo-EMに基づくSPT複合体の構造解析
SPTLC2遺伝子の新規変異は、ORMDL3(SPTの活性を調節するサブユニット)に隣接した膜関連領域に位置しています。
同様にSPTを構成するSPTLC1遺伝子のORMDL3に近接した部位の変異も、若年発症のALSの原因になることが報告されています。
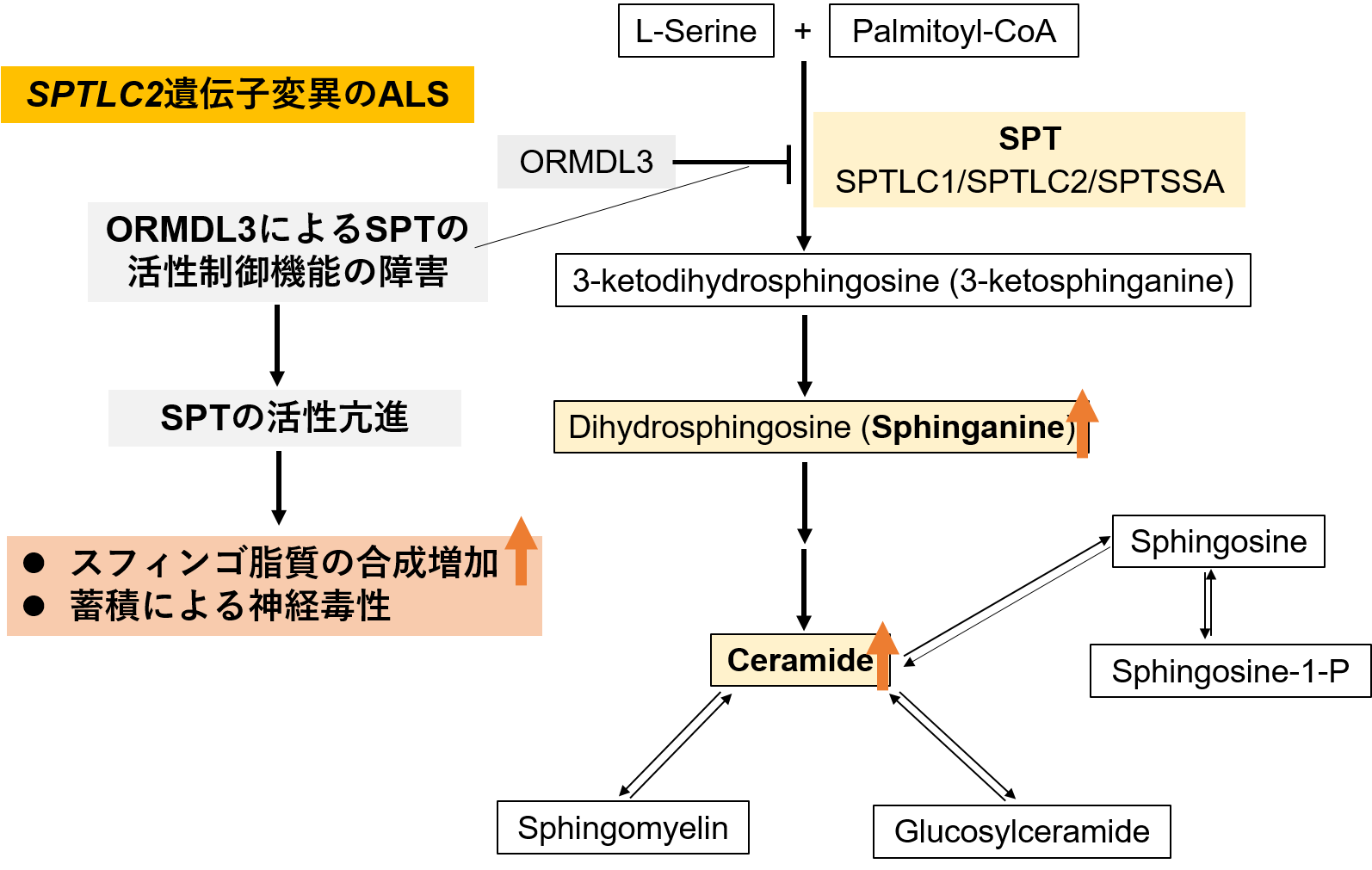
図3:スフィンゴ脂質のde novo合成経路
SPTの活性は、SPT複合体を構成するORMDL3による調節を受けています。
ORMDL3に隣接する領域のSPTLC2遺伝子の変異により、ORMDL3によるネガティブフィードバックが障害されると、SPTの活性が亢進し、スフィンゴ脂質の合成増加、蓄積による神経毒性が生じると考えられます。
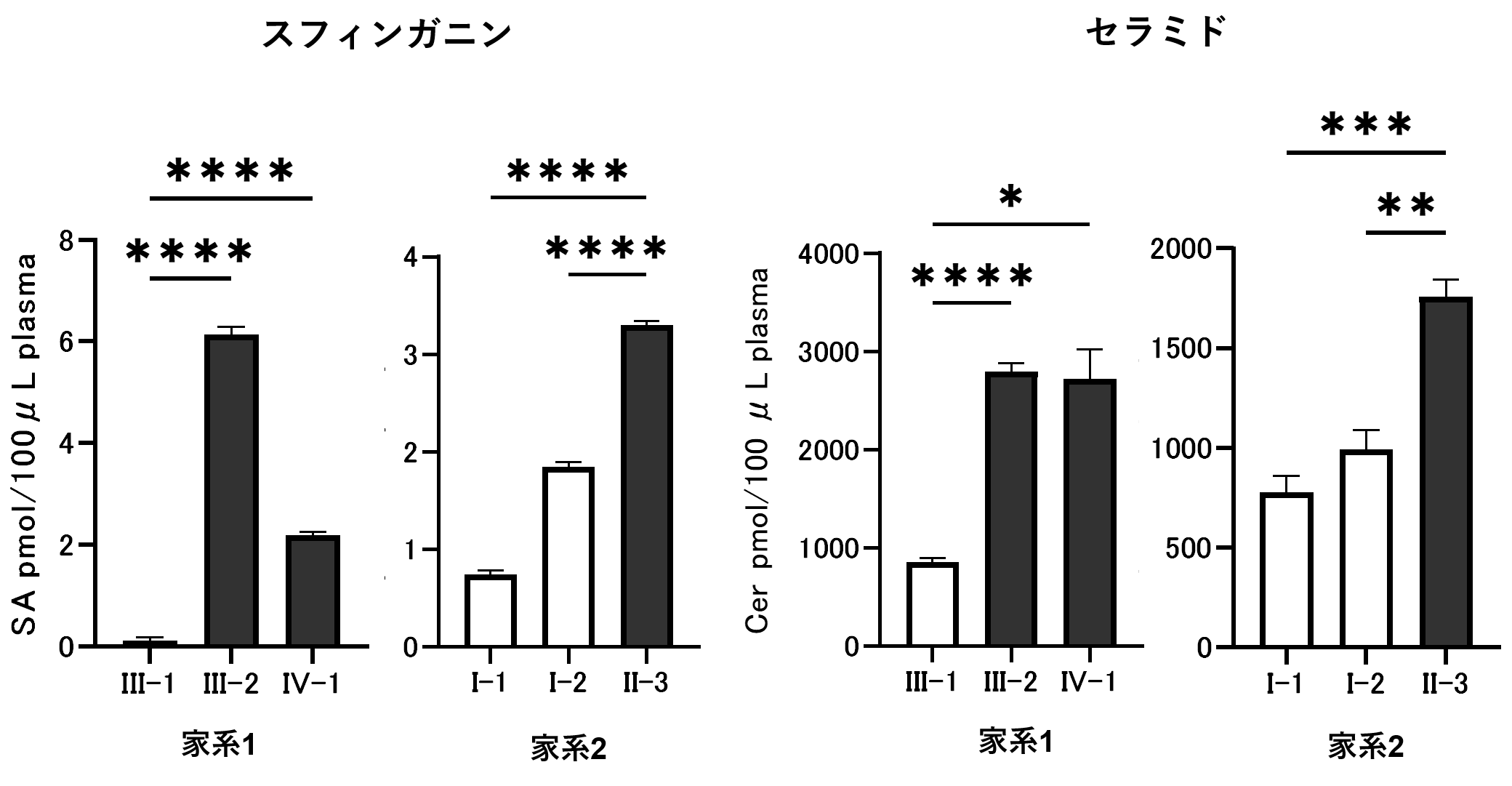
図4:若年発症のALS家系内の発症者と非発症者の血漿検体を用いた脂質分析
ALS家系内の発症者と非発症者間で比較すると、発症者群で血漿中のスフィンガニンとセラミドの有意な増加が観察されました。
3.社会的意義や今後の予定
ALSの新規原因遺伝子の同定は、ALSの遺伝的病因と病態解明のために非常に重要です。近年脂質代謝異常とALSの病態の関連を示す研究データが蓄積されていますが、脂質代謝に直接関連するALSの原因遺伝子の同定は進んでいませんでした。本研究により、若年発症のALSおよびFTDの原因としてSPTLC2遺伝子を新たに同定し、変異を有する患者におけるスフィンゴ脂質の代謝異常が観察されたことは、ALSの病態と脂質代謝障害を遺伝学的・生化学的に直接関連付ける意義深い結果といえます。SPTLC1遺伝子の変異が若年発症のALSの原因であるという最近の知見と合わせて、SPT関連遺伝子がALSの病態に重要な役割を果たし、特にスフィンゴ脂質の代謝異常がALSの病態メカニズムに深く関与していることが明らかになりました。今後は脂質代謝障害の病態への寄与について、ALSやFTDの幅広い症例を対象に検討していく予定です。
そして本研究から、若年発症のALSとFTDの病態に、SPTの活性亢進によるスフィンゴ脂質の産生増加が関わっていることがわかりました。これはセラミドなどのスフィンゴ脂質の過剰合成を抑制し、スフィンゴ脂質の量を適切にコントロールすることが、ALS治療の選択肢になることを示しています。特定の脂質代謝異常を是正することにより、新たなALSの治療法の開発につなげたいと考えています。
論文情報
雑誌名
Annals of Clinical and Translational Neurology
論文タイトル
SPTLC2 variants are associated with early-onset ALS and FTD due to aberrant sphingolipid synthesis
著者
Hiroya Naruse, Hiroyuki Ishiura, Kayoko Esaki, Jun Mitsui, Wataru Satake, Peter Greimel, Nanoka Shingai, Yuka Machino, Yasumasa Kokubo, Hirotoshi Hamaguchi, Tetsuya Oda, Tomoko Ikkaku, Ichiro Yokota, Yuji Takahashi, Yuta Suzuki, Takashi Matsukawa, Jun Goto, Kishin Koh, Yoshihisa Takiyama, Shinichi Morishita, Takeo Yoshikawa, Shoji Tsuji, Tatsushi Toda*
DOI
https://doi.org/10.1002/acn3.52013
掲載日
2024年2月5日(オンライン)
研究者
戸田達史(東京大学大学院医学系研究科 神経内科学 教授/東京大学医学部附属病院 脳神経内科 科長)
成瀬紘也(東京大学大学院医学系研究科 プレシジョンメディシン神経学 特任助教)
研究体制と支援について
本研究は、東京大学大学院医学系研究科を中心とする共同研究としておこなわれました。研究の実施にあたっては、日本医療研究開発機構(AMED)難治性疾患実用化研究事業の支援を受けて実施しました。
用語解説
(注1)スフィンゴ脂質:
スフィンゴイド塩基とよばれる長鎖アミノアルコールを骨格としてもつ脂質の総称で、細胞膜の主要構成脂質の一つ。アポトーシスや細胞増殖など様々な細胞機能を制御している。SPTはセリンとパルミトイルCoAを基質とし、スフィンゴ脂質の生合成の初発かつ律速の酵素であり(図3)、その活性変化がスフィンゴ脂質の総量を制御している。
(注2)脂質分析:
発症者および非発症者の血漿検体を採取し、脂質を抽出した。その後液体クロマトグラフィー質量分析法(LC-MS)による解析を行い、スフィンゴ脂質の濃度を測定した。
(注3)次世代シーケンサー:
2000年代後半から実用化された、従来型のキャピラリー型シーケンサーのスループットを凌駕するシーケンサー。遺伝子のエクソン領域を効率的に解析するエクソーム解析が研究・診断に積極的に用いられるようになり、神経疾患の遺伝学的研究は大きく発展した。
(注4)新生突然(de novo)変異:
親から受け継いだ変異ではなく、ある個体において新しく発生した変異。発症者(発端者)と非発症の両親の計3名の遺伝子解析(トリオ解析)を実施し、両親に見られず発端者のみに見られる遺伝子変異をde novo変異と考える。
参考文献
1.Naruse et al. Molecular epidemiological study of familial amyotrophic lateral sclerosis in Japanese population by whole-exome sequencing and identification of novel HNRNPA1 mutation. Neurobiol Aging. 2018 Jan;61:255.e9-255.e16. doi: 10.1016/j.neurobiolaging.2017.08.030
2.Naruse et al. Burden of rare variants in causative genes for amyotrophic lateral sclerosis (ALS) accelerates age at onset of ALS. J Neurol Neurosurg Psychiatry. 2019 May;90(5):537-542. doi: 10.1136/jnnp-2018-318568
3.Rotthier et al. Mutations in the SPTLC2 subunit of serine palmitoyltransferase cause hereditary sensory and autonomic neuropathy type I. Am J Hum Genet. 2010 Oct 8;87(4):513-22. doi: 10.1016/j.ajhg.2010.09.010
4.Mohassel et al. Childhood amyotrophic lateral sclerosis caused by excess sphingolipid synthesis. Nat Med. 2021 Jul;27(7):1197-1204. doi: 10.1038/s41591-021-01346-1
5.Johnson et al. Association of Variants in the SPTLC1 Gene With Juvenile Amyotrophic Lateral Sclerosis. JAMA Neurol. 2021 Oct 1;78(10):1236-1248. doi: 10.1001/jamaneurol.2021.2598