
脳・脊髄・末梢神経疾患を対象として治療を行い、多くの脳神経外科疾患の診療経験を有する。これらの疾患は、脳出血・クモ膜下出血・脳梗塞などの脳血管疾患、脳ドックの普及によって発見される頻度が高まった未破裂脳動脈瘤、比較的まれだが治療が困難な脳脊髄動静脈奇形・良性/悪性脳腫瘍・脊髄腫瘍・末梢神経腫瘍、機能的疾患として三叉神経痛・顔面けいれん・脊椎疾患・てんかん・パーキンソン病・振戦などが占めている。これらの疾患の確実な診断法・安全な治療法の確立が重要である。本研究はこれらの脳・脊髄・末梢神経疾患の臨床的特徴を明らかにし、診断法、治療法を改善することを目的とする。本臨床研究により、脳・脊髄・末梢神経疾患についての広く正しい知見が得られる意義がある。方法として、脳・脊髄・末梢神経疾患の観察研究(生体試料を用いないカルテ調査)を行い、これらの疾患の臨床的特徴、画像診断法、手術治療法、血管内治療法、ガンマナイフ治療法、化学療法・放射線治療法などを研究する。保有する個人情報に関しては、本研究のみに用いる。これらの匿名化を行い、プライバシーを確保し、東京大学附属病院・脳神経外科病歴室で施錠管理する。学会にデータを発表する場合は、個人データは発表されない。個人情報の開示など個人情報に関する問い合わせは03-3815-5411。現在研究進行中の臨床研究は次の通りである。
脳神経外科疾患の原因を明らかにし、その診断法、治療法を改善することを目的として、
その病理組織・遺伝子・ゲノム解析研究を行っている。
方法として、匿名化した手術検体(病理検体)や正常血液を収集・保存し、DNA、RNA、蛋白質などを抽出し、これらにおける、疾患特有の異常などの解析を施行している。遺伝子・ゲノム解析には、次世代シークエンサーなどを利用した網羅的な解析が含まれる。過去に収集した検体試料を利用する場合は、新たに当院倫理委員会の承認を受けた上で、適切な匿名化を行ったうえで研究施行している。個人情報の開示など個人情報に関する問い合わせは03-5800-8853(脳神経外科担当・田中 將太、宮脇 哲、高柳 俊作)。
現在研究進行中の研究は次の通りである。
東京大学脳神経外科では、新たな治療法を開発・検証する臨床試験を数多く行っており、脳腫瘍患者さんの未来のためにも、今後のよりよい治療法の選択への貢献をしていきたいと考えています。
| 神経膠腫に対する化学療法(抗がん剤)有効性の比較検討 | JCOG 1303 | 初発グレードII星細胞腫に対し、テモゾロミド(テモダール®)の効果を検証するランダム化第III相試験DARTS(UMIN000014578) |
|---|---|---|
| JCOG 1016 | 初発退形成性神経膠腫に対し、テモゾロミド治療に先立って行う塩酸ニムスチン(ACNU)の有効性を検証するランダム化第III相試験SANTA(UMIN000014104) | |
| JCOG 1308 | 再発膠芽腫に対し、ベバシズマブ(アバスチン®)治療に先立って行う用量強化テモゾロミドの有効性を検証するランダム化第III相試験(NCT02761070) | |
| JCOG 1703 | 初発膠芽腫に対する可及的摘出術+カルムスチン脳内留置用剤留置+テモゾロミ ド併用化学放射線療法と可及的摘出術+テモゾロミド併用化学放射線療法のランダム化第 III 相試験(jRCT1031190035) | |
| 悪性リンパ腫初期治療におけるテモゾロミド抗がん剤の有効性の検討 | JCOG 1114 | 初発悪性リンパ腫に対し、大量メトトレキサート療法にテモゾロミドを加える効果を検証するランダム化第III相試験(UMIN000008535) |
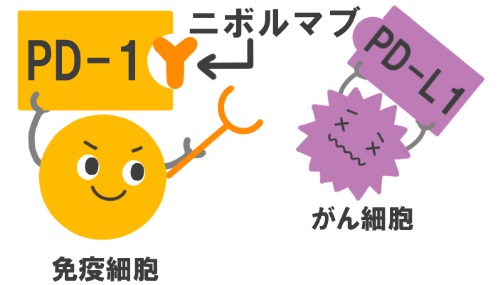
がんは患者さん(宿主という)の体にとっては異物であって、本来であれば宿主の免疫によって排除されるべきです。しかしがん細胞は、免疫を逃れるためにさまざまなメカニズムを働かせています。免疫を担う重要なリンパ球であるT細胞の表面にある、PD-1というタンパクに対する受容体をがん細胞が出し、T細胞の活性を抑えるというのもその一つです(図参照)。PD-1に対する抗体であるニボルマブに代表される免疫チェックポイント阻害薬は、いわばがんが宿主の免疫にかけているブレーキを外してがんに対する免疫を高める効果をもち(図参照)、今がん治療でとても期待されている治療薬のひとつです。ニボルマブ(静脈内投与)は、日本ではすでに皮膚がん(悪性黒色腫)と肺がん、腎がんに対して保険承認されています。
神経膠腫、特に膠芽腫では一般にPD-1の発現が高いため、ニボルマブがよく効くのではないかと期待され、今回の治験が計画されました。

初発の膠芽腫を対象とした多施設共同の企業主導治験です。初発に対する2つの治験は国際共同試験になります。本試験は安全性,有効性をみるための試験です。
主な参加基準は以下の通りとなります。
その他にも多くの参加基準があり、治験に参加いただくためには当院で検査・診療を受けていただく必要があります。参加ご希望の患者さんは、まず主治医にご相談いただき、紹介状をご用意のうえ、当科初診外来を受診ください。
クモ膜下出血を来す原因であるが、その対処について数々の疑問が投げかけられている未破裂脳動脈瘤に関して、当科独自の症例研究以外に脳神経外科学会が推進する悉皆調査(UCAS Japan)の事務局としてインターネットを利用した全国疫学的調査の中心として機能している。現在7000例超の症例の追跡を行っている。未破裂脳動脈瘤の分布、自然歴、および治療成績について様々な知見を得ている。また2006年度より厚生労働省班研究uCARE研究の一部としてUCAS IIとして全国30施設における前向き未破裂脳動脈瘤QOL調査が開始された。本調査はもともと無症候な未破裂脳動脈瘤を疾患として扱うにあたり、未破裂脳動脈瘤の診断や治療が患者の社会生活や意欲等に与える影響を前向きに大規模なデータを得ようとしている研究である。さらに三次元画像の解析により動脈瘤形状の自然暦に及ぼす影響の長期経過観察を経て行う予定である。
頭蓋内疾患の外科治療前に、機能MRI, 脳磁図、脳白質画像(tractography)などの脳機・代謝能画像を駆使して、患者毎に非侵襲的に脳機能マッピングを行っている。これらにより主に運動・言語関連機能脳内ネットワークの画像化が実用化し、あらゆる脳神経外科手術計画の立案に応用している。これらの画像情報をニューロナビゲーター装置上に表示することで術中に機能的に重要な領域の温存を可能とさせた。術前検討は電気生理学的モニタリング手法(電気刺激、脳皮質電位計測)により検証することで、より正確、かつ詳細な脳機能マッピング方法の確立に努めている。また、全ての画像データを3DCGとして描出した手術シミュレーションを行い、詳細な術前検討が可能になった。
抗てんかん薬で発作を抑制できない薬性抵抗性の難治性てんかんのうち、側頭葉てんかんなど一部の患者には、既に標準化された外科治療法が存在するが、多くの患者には根本的な治療法が存在しない。これまで積極的治療の対象外だった難治度の高いてんかんを対象として革新的検査手法や治療法の開発を行い、評価・標準化を目的とした研究を行っている。
検査手法に関しては、頭皮脳波装着時に用いるペーストの開発を本学工学部との共同研究として行っている他、多施設共同研究として、MRI陰性てんかんの焦点診断を目的とした核医学検査・脳磁図を基盤とする統合的解析法の開発、てんかん診断支援AIの開発などを行っている。また、てんかん焦点局在診断の精度向上やてんかん原性機構の解明を目指して、次世代型頭蓋内電極の開発研究も継続している。
治療法に関しては、側頭葉てんかんに対する選択的扁桃体海馬切除術や機能温存的手術手技として開発された軟膜下皮質多切術や海馬多切術について、手術の安全性を高める工夫やその有効性の評価を続けている。手術検体を用いた治療抵抗性の原因理解と治療戦略構築を目的とした多施設共同研究も実施している。また、緩和的治療法である脳梁離断術や迷走神経刺激療法についてもその有効性や安全性などを評価する目的で当施設を含む多施設共同研究を行っている。特に迷走神経刺激療法は薬事承認前より研究医療として施行を開始し、本邦導入の契機となった。国内最多の症例数を生かし国際多施設共同研究に参加するとともに、独自に治療効果の術前予測法や最適な刺激設定法を確立するための研究を行っている。
頭蓋底部の腫瘍や脳深部の脳動静脈奇形など従来治療困難と考えられていた疾患もわが国で初めてガンマナイフを導入することによって治療成績が向上している。特に当教室では脳動静脈奇形の治療の研究において一定の成果を上げている。画像上の治癒率のみならず、治療後の出血リスクの詳細な解析を報告し(NEJM 352:146-53)、国内外より高い評価を得ている。また、世界に先駆けてMRIによる拡散テンソルtractographyを治療計画に統合することにより、治療に際して運動線維など脳の重要な白質路への線量を確認することを可能にした。これにより合併症の発生率を確実に低下させることが可能となり、ガンマナイフ治療の安全性を向上させた。今後は治療機のバージョンアップによる治療精度の向上、3テスラMRI画像の治療への応用などを予定している。
手術をはじめ診断・治療技術の進歩にもかかわらず、悪性神経膠腫の治療成績は50年来さほど向上しておらず、新しいアプローチによる治療法の開発が必要です。我々は悪性脳腫瘍患者に対する治療の成績向上を目指し、様々な視点から研究を行っています。
脳腫瘍の遺伝子解析においては、手術で摘出した神経膠腫組織の遺伝子変異のシークエンス解析(IDH遺伝子、ヒストン遺伝子、TERT遺伝子プロモーターなど)や、1p, 19q, 10qのマイクロサテライト解析、Methylation-specific PCR法によるMGMTプロモーターのメチル化解析を行い、結果に基づき治療の最適化を行っています。また、網羅的遺伝子発現・メチル化解析を加えた、新たな分子マーカーや治療標的の同定のための研究を行っています。さらに、von Hippel-Lindau病(VHL病)やNF2などの家族性脳腫瘍や原発性脳腫瘍を対象として種々の遺伝子異常を検索し、その結果を患者の病歴などと照合を行うことで、これらの関連性を明らかにするための研究を行っています。
また、悪性神経膠腫の手術検体より、治療抵抗性の一因と考えられている神経膠腫幹細胞を単離し細胞株を樹立しています。これに対する特異的な治療法の開発研究を検討しています。
さらに、基礎の研究室と共同で、脳腫瘍(特に悪性神経膠腫)の術中の同定を容易にし、摘出度を向上させて患者予後を改善させるための、新たな蛍光プローブの開発研究を行っています。膠芽腫などの悪性神経膠腫に有効な蛍光プローブに関して国内および国際特許を出願し、実用化に向けて、国立研究開発法人日本医療研究開発機構(AMED)「革新的がん医療実用化研究事業」として非臨床試験を行っています。
成体脳における神経幹細胞の存在が明らかになってから、これらの細胞を用いて神経細胞の再生を試みる治療法が研究課題となってきた。当研究室では、成長因子投与によって内因性神経幹細胞を賦活化し、脳虚血によって死滅した海馬の神経細胞を40%再生させることに動物モデルにて世界に先駆けて成功した。現在、海馬以外の部位での神経再生にも有る程度成功している。また、霊長類での研究にも着手して基礎研究を続け、将来的な臨床応用への可能性を探っている。また、成体の各部位に幹細胞が存在し、その一部は神経細胞に分化し得ることも分かってきた。我々は、特に皮膚由来幹細胞に注目して脳内への移植を行い、神経細胞への分化条件などを検索している。従来は中枢神経系の再生は不可能と考えられてきたが、これらの各種治療法の可能性が現実的なものをなりつつあり、血管障害を含めた損傷脳の機能再建にむけて、さらに研究を積み重ねて行く予定である。
機能的MRI、脳磁図、NIRSを用いた大脳機能研究の他、当科の特色とも言える頭蓋内脳波を用いた脳機能研究を進めている。てんかん外科治療において長期頭蓋内に留置された硬膜下電極からは、高い空間解像度とSN比で大脳皮質の電気活動を記録でき、また電気刺激による介入も可能である。これらの侵襲的検査で得られた情報を統合してネットワークとしての脳機能を明らかにし、非侵襲的検査の精度向上へ繋げることを目的として研究を行っている。硬膜下電極から得られる皮質脳波はbrain-computer interface (BCI)の情報源としても有力であり、医学部他教室や工学系研究室との共同により、主に意思伝達・運動制御を目的としたBCI研究への発展を目指している。
脳血管障害に対する血管内治療は低侵襲でありながら直達手術と同等ないしそれ以上の効果をもたらしうる治療として現在急速にその適応が広がっています。一方で新規の治療機器を実際に使用した際の成績や従来血管内治療が対象にならなかった疾患に対する新しい治療の成績,稀な疾患の治療の成績,および治療後の患者の長期の経過や予後につき実際の成績をまとめたデータはいまだに十分とは言えません。東大病院では国内の関連する医療機関と連携し,脳神経血管内治療を受けた患者さんのデータベースを作成し、患者さんが治療後どのように経過しているか解析しています。
東大病院で行っている個別の血管内治療関連の研究について,詳しくは以下のリンクを参照ください。