グリオーマの治療は、手術、放射線治療、化学療法(抗がん剤)が標準的な治療法です。しかし残念ながら、これらの標準治療をもってしても治療が難しい患者さんが数多くおられます。そこで東大病院では、これらの標準的な治療を確実に行うとともに、新しい治療法についても積極的に取り入れながら、個々の患者さんにおいて最適と思われる治療を提供しています。
通常CT・MRI検査により脳そのものから発生した腫瘍病変として指摘されます(図1)。最終的な診断は、手術で採取した検体を用いた病理検査で初めて確定されますが、手術前にグリオーマの確からしさをなるべく高める、すなわち、がんの脳転移やその他の脳腫瘍でないという確信をもてる持てることは重要です。そのために、MRスペクトロスコピーやPET(Positron Emission Tomography)、SPECT(Single Photon Emission CT)といった特殊な放射線検査を追加することがあります。
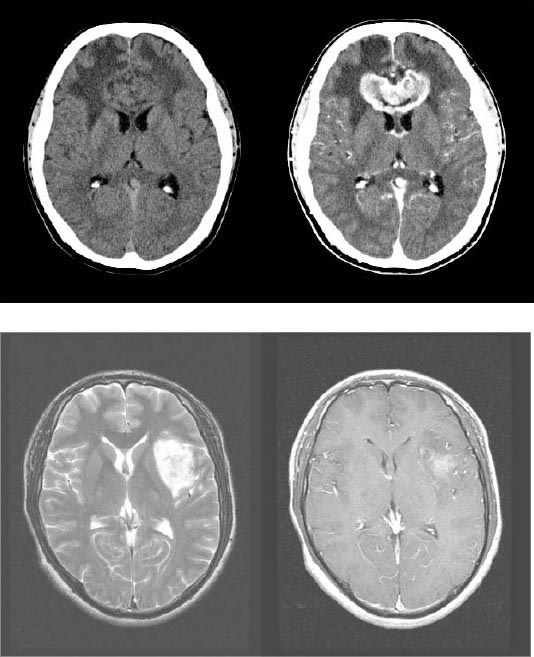
図1:グリオーマのCT(上)・MRI(左下)画像。上の患者さんでは、単純CT(左上)にて両側前頭葉に広範な脳浮腫を認め、造影CT(右上)にて脳梁部に造影される腫瘍を認めました。下の患者さんでは、MRIT2強調画像(左下)にて左島と呼ばれる部分に腫瘍を認め、造影MRI(右下)にて一部が淡く造影されました。
脳腫瘍の診断には、ブドウ糖の取り込みを調べるFDG-PETや、神経膠腫の浸潤領域をより正確に可視化できる、アミノ酸の取り込みを調べるPETトレーサー「フルシクロビン(18F)、アキュミン」が使用可能となります。これにより、手術前の診断だけでなく、今後は放射線治療後の腫瘍再発と放射線の影響を鑑別する際にも有効な可能性があります。
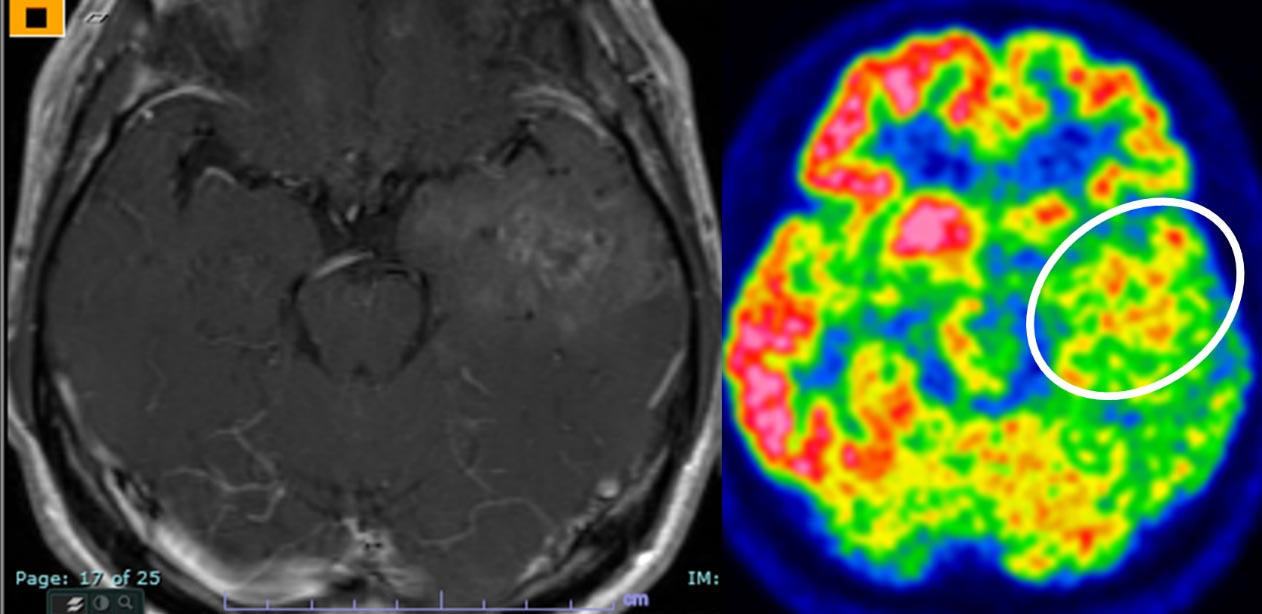
図2:FDG-PET。左側頭葉の膠芽腫の患者さんです。FDG-PET画像(右)にて高集積の部分が特に活動性が高いと判断され、この部分を余すところなく摘出することになりました。
グリオーマの手術をなるべく安全に執り行うために、適切な脳機能評価が不可欠です。東大病院では、通常のCT・ MRI検査などに加え様々な検査を必要に応じて行います。例えば以下のような最先端の技術を用いることで腫瘍と脳の大事な領域との関係を知ることができ、障害を出さずに腫瘍を最大限摘出するための手術戦略を立てることができます。
高画質で安定した画像が得られる3テスラMRIを用いて、言語や運動の課題をしながら撮影することにより、優位半球前頭葉の言語野や細かい動きに対応する脳の領域を同定することができます(図3)。
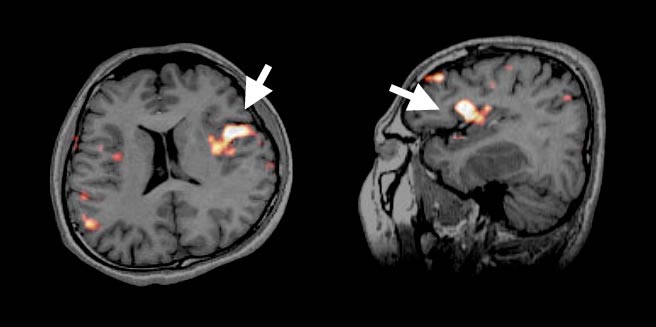
図3:言語課題をしながら撮影したMRI。言語野の血流が増加し、画像で同定されます。
トラクトグラフィーは、運動や言語の機能を担う神経線維を詳細に描き出し、腫瘍との位置関係を明確に示す検査です。これにより、手術時に重要な神経を保護し、機能障害のリスクを低減することが可能となります(図4・5)。覚醒下手術のプラニングをする際に重要な情報です。全身麻酔下での手術の患者さんに対しても行っております。
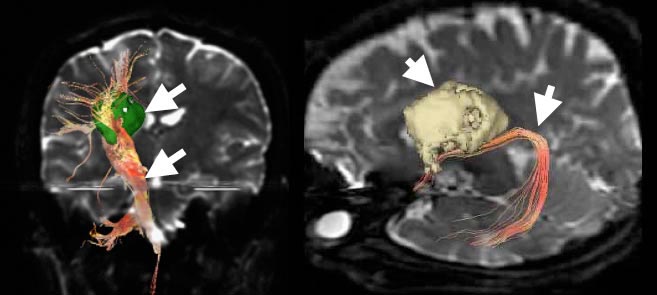
図4:腫瘍に近接する脳の神経線維を3次元的に描き、位置関係を示しています。
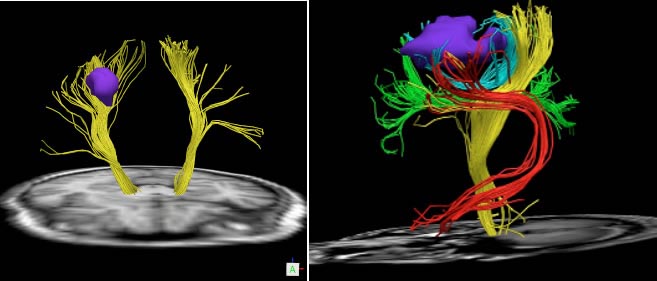
図5:Q-ballを用いたトラクトグラフィー。様々な方向に伸びる運動神経線維に加え、言語機能・視覚線維の走行も正確に描くことができます。
東京大学脳神経外科が誇る融合三次元画像作成技術を駆使し、MRI、CT、血管撮影、トラクトグラフィーなどの情報を融合させ、腫瘍と脳機能局在の関係を正確に把握し、手術を安全に行うための術前シュミレーションを行っております (図6)。
患者さんにもお見せします。腫瘍を最大限摘出することと、周囲の重要な神経ネットワークを温存すること、この2つを両立させることは容易ではありません。術前に3D画像を利用できることで、手術を行う東大脳外科チームはより正確な手術プラニングと安定した手術操作が可能となります。東大病院での脳腫瘍手術では、もはや欠かせないテクノロジーです。
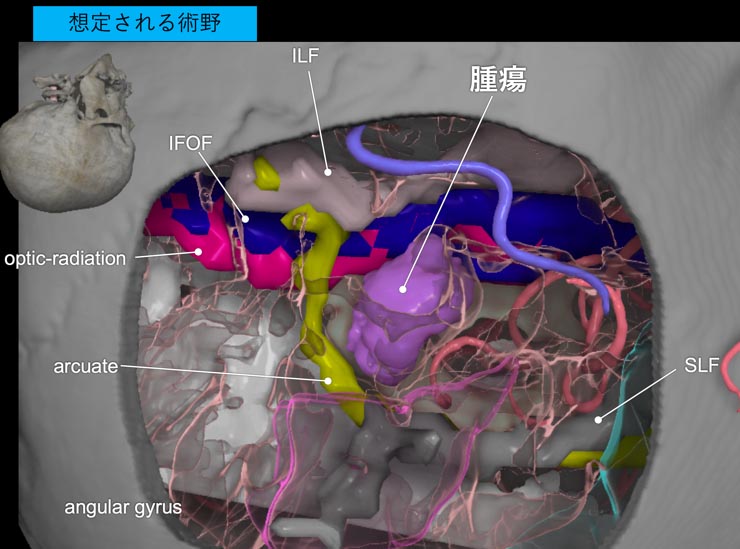
図6. 左側頭葉膠芽腫に対して作成した融合3次元画像。腫瘍と血管、言語機能、視覚繊維との関係をシュミレーションし、術前検討に役立てました。
脳機能を調べる方法で、日本でも限られた施設でのみ可能な非侵襲的な検査です。
グリオーマにおいては、手術でできるだけ腫瘍を取り除くことが予後の改善につながります。しかし腫瘍の部位によっては、摘出により麻痺、言語障害、意識障害などの重篤な合併症が起こる危険性が高いと判断され、そうした合併症自体がかえって予後に悪影響を及ぼすという報告もありますので、その場合には診断のみを目的とした生検を行います。
東大病院では、前述のような検査を駆使して脳の大事な領域と腫瘍との関係を同定し、さらに下記のような様々なテクノロジーや新たな薬剤、革新的な手法を手術に導入することにより、生活に支障をきたすような症状の悪化を生じない範囲で、出来る限りの腫瘍の摘出を目指します。その様な手術は、執刀医はもとより、各分野に精通した医師らによる緊密な協力体制により成り立っています。
こうした術前の精密検査や術中の手術支援技術は、再発をきたしたグリオーマに対しても有用で、東大病院では適応があれば再手術を積極的に検討しています。
車のナビゲーション(カーナビ、あるいはGPS)のように、脳腫瘍の手術でもナビゲーションシステムが有用です。手術している箇所が画像上どこに位置するかがリアルタイムに分かるので、術者は重要な脳領域や神経線維までどれだけ離れていてどこまで安全に摘出しうるのかを、判断することができます(図6)。東大病院ではメドトロニック社のS8という最新の機械を導入しております。
また東大病院では、大事な脳領域・神経線維や血管の走行などと腫瘍の画像や術中の画像を融合させる技術を開発しており、安全確実な手術をサポートしています(図7・8)。

図6:ナビゲーションシステム。腫瘍、重要な脳領域、神経線維の位置情報を術中に示すことにより、安全でより確実な手術を可能にします。
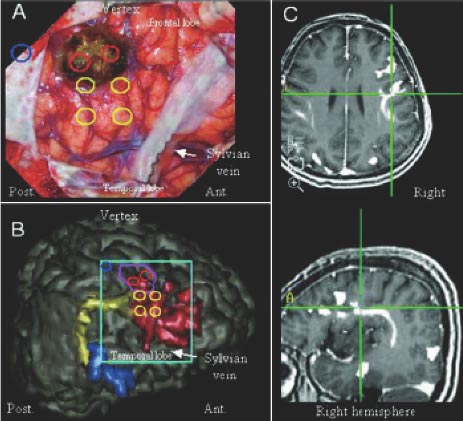
図7:機能MRIやトラクトグラフィー、脳磁図などを統合して画像を作成し、ナビゲーションシステムおよび覚醒下手術(後述)を用いて安全確実な手術を目指します。
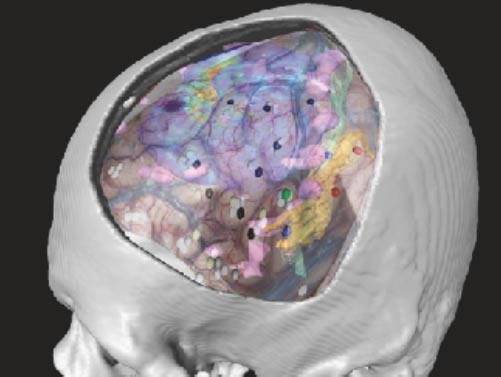
図8:融合三次元画像による脳機能マッピング
手術によりダメージを受ける可能性のある脳及び脳神経の機能を術中に監視し、術後の機能障害(麻痺や視野障害など)のリスクを軽減することを目的とした手術支援システムです。
脳機能のモニタリングとしては、以下のものを行っています。
東大病院では、モニタリング機器であるニューロマスター(図9)を使用して、上記のすべてのモニタリングを行うことができます。
図9:ニューロマスター((株)日本光電)
通常の手術用顕微鏡で観察するだけでは、腫瘍と正常脳との境界が分かりづらいことが多々ありますが、特に運動や言語など重要な機能を担う脳領域の近くの腫瘍を扱う際には、正常脳を傷つけずに腫瘍をできる限り摘出することが重要です。手術中に5-アミノレブリン酸(5-ALA)という蛍光プローブを用いると、特殊な光のもとで腫瘍がピンク色に染まるため、より正確に腫瘍摘出を行うことができます(図10)。実際、ドイツで行われたランダム化比較試験で、5-ALAを用いた方が腫瘍の全摘出の割合が上がったと報告されました。
患者さんは、手術当日の朝に5-ALAを内服していただくだけです。副作用として光線過敏症がありますので、術後2日間は明るい光への露出を控えていただきます。
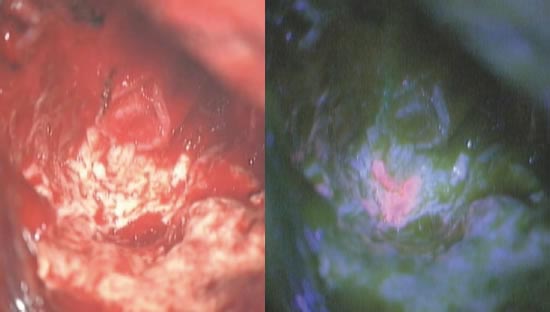
図10:5-アミノレブリン酸。摘出腔の最深部にて、通常の手術用顕微鏡(左)では難しい腫瘍と正常脳との区別が、5-ALA(右)を用いると容易に可能です。
覚醒下手術(awake surgery)は、言語や運動機能を担う重要な脳領域に近い腫瘍の摘出に用いられる技術です。患者さんに手術中に目を覚ましていただき、会話を通じた言語機能や手の動きなども確認しながら、リアルタイムで機能をモニタリングします。これにより、症状を悪化させることなく最大限の腫瘍摘出を行います。局所麻酔が行われているため、痛みは感じにくい状態が保たれています。
たとえば、優位半球前頭葉に膠芽腫がある患者さんでは、運動や言語機能に接する腫瘍の摘出が必要でしたが、ナビゲーションガイド下で覚醒下手術を行うことで、重度の麻痺や言語障害を残さずに腫瘍をほぼ全摘出できました(図11)。
多くの施設では優位半球(左大脳半球)の病変に対して覚醒下手術が行われています。東大病院では非優位半球(右大脳半球)の役割も重視しております。左手の細かい動き、左側の空間の認識、見えるものを認識する能力、高度な知的機能は右大脳半球にあります。これらを手術によってむやみに損傷しないように、東大病院では右大脳半球の病変に対しても覚醒下手術を行っております。
この手術は、術後の後遺症を最小限に抑え、患者さんの生活の質を保つために非常に有効です。
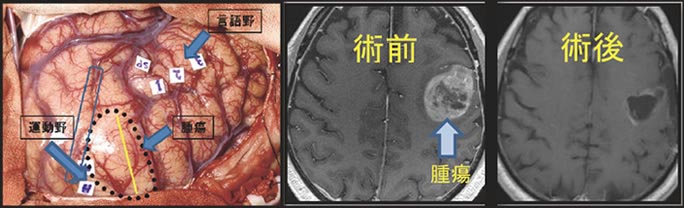
図11:術中写真と手術前後のMRI画像
腫瘍の病理診断は、脳腫瘍に関して経験豊富な病理診断医によってなされます。さらに従来の病理診断に加えて、遺伝子解析や分子病理診断を追加して腫瘍の性質を見極め、適切な術後治療(放射線治療、化学療法など)の選択を行うことを目指しています。
乏突起細胞系腫瘍が疑われる患者さんに対しては、腫瘍における染色体1番短腕、19番長腕の欠失を全例において調べ(図12)、診断と治療法選択の参考にしています。現在では一般に広く行われるようになった検査ですが、当院においては有効性の最初の報告があった平成10年頃より継続してこの検査を行っており、長年にわたり多くの経験を重ねています。この検査は現在、MLPA(Multiplex Ligation-dependent Probe Amplification)を用いて行われており、より正確かつ迅速に結果を得られるようになっております。
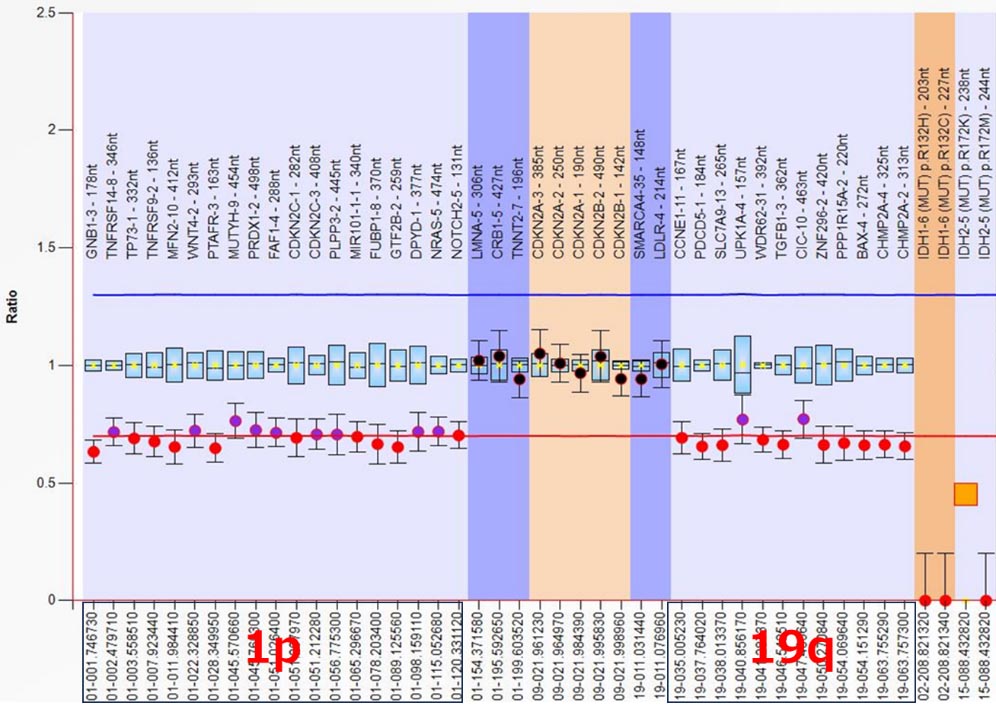
図12:染色体欠失の検査の一例。染色体1番短腕と19番長腕に設計したプローブの部位が基準線より低下しており、診断に欠かせない検査結果となりました。
MGMTという遺伝子のプロモーター領域のメチル化の状態によって、化学療法に対する反応や予後が異なることが報告されています。東大病院では以前より、摘出した神経膠腫のDNAを使用し、メチル化特異的PCR(methylation specific PCR, MSP)という方法でメチル化解析を行い(図13)、治療法を検討する上での参考にしてきました。
最近になり、特に高齢の神経膠腫の患者さんにおいては、このMGMT遺伝子プロモーターのメチル化検査を参考にすることで、手術後の治療として放射線治療か、化学療法(テモダール®内服による抗がん剤治療)かを適切に選択することができ、これが患者さんの状態をよく保ちながら生存期間を延ばすことに役立つことが分かってきました。そこで東大病院では、厚生労働省より先進医療 「抗悪性腫瘍剤治療における薬剤耐性遺伝子検査」施行の承認をうけて、このMGMT遺伝子プロモーターのメチル化検査を手術後速やかに施行することで、このような患者さんの治療結果の向上に努めています。
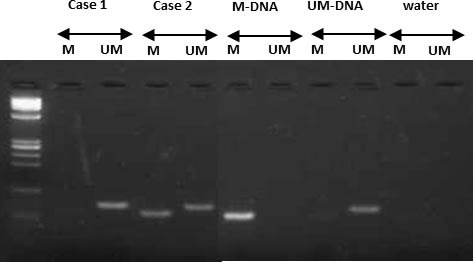
図13:メチル化特異的PCR
IDH1遺伝子はイソクエン酸デヒドロゲナーゼ1という代謝酵素の設計図となる遺伝子ですが、神経膠腫の多くがこの遺伝子の異常により発生することが、最近の研究で分かってきました。大事なことは、このIDH1遺伝子異常の有無を調べることで、神経膠腫の診断や治療効果の予測がより正確にできるようになるということです。
そこで東大病院では、腫瘍組織の染色や図14のようなサンガーシークエンス解析を用いて、この遺伝子異常を判定することに以前より取り組んでおり、診断や治療の参考にしてきました。
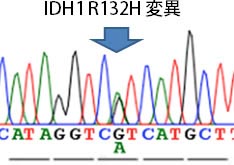
図14:IDH1 R132Hシークエンス解析
悪性グリオーマの多くは、術後に放射線照射と化学療法を行うことで生存期間が延長することが証明されており、標準的には腫瘍局所に総線量60Gyを6週間(1か月半程度)かけて分割照射します。東大病院では、高性能放射線照射装置(図15)を用いコンピューターで照射野を計算して精密な照射を行っています。さらには強度変調放射線治療(intensity-modulated radiation therapy, IMRT)といって、照射対象内でも放射線の強度に変化をもたせる(凹凸を作るイメージ)照射方法を用いると、視神経や海馬など放射線感受性の高い組織あるいは重要な脳領域に腫瘍が接していた場合など、周囲へのダメージが少なく済みます。
高齢の患者さんには、6週間の分割照射と同等の効果を期待できると報告される3週間の分割照射(総線量40Gy)を行うこともあります。
図15:高度イメージガイド下放射線治療装置での放射線治療
再発時には、腫瘍の種類と再発の仕方によってはガンマナイフの適応になることもあります。東大病院では、1990年に日本で初めて導入されて以来、脳外科領域の他疾患に対して世界有数の経験を持っており、必要な際は東大病院にて迅速にガンマナイフを行うことができます。
悪性グリオーマに対しては、多くの場合で放射線治療に加えて化学療法(抗がん剤)が用いられます。
テモダール®は日本では2006年7月より保険適応となった内服薬で、初発悪性グリオーマに対する世界的な標準治療薬です。東大病院では、保険適応以前より患者さんに投与をしており、豊富な使用経験を積んでいます。放射線治療の期間中患者さんは毎日内服し、終了後一旦休止ののち、副作用の程度を確認しながら、外来にて継続投与を行っていきます。外来通院は1か月に一度程度です。参考までに標準的なスケジュールを図16に示します。
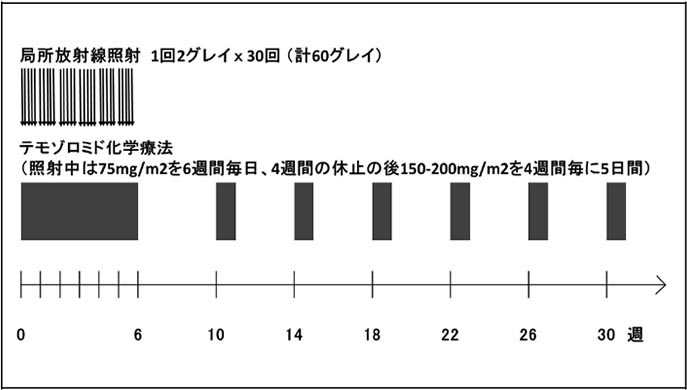
図16:初発悪性グリオーマの治療スケジュール
分子標的治療は、体内の特定の分子を狙い撃ちしてその機能を抑えることにより病気を治療する治療法です。癌細胞と正常細胞の違いをゲノムレベル・分子レベルで解明し、癌の増殖や転移に必要な分子を特異的に抑えることで治療するため、効果を期待できる一方で従来の化学療法に比べ副作用を少なく抑えることが可能です。
新生血管を抑える効能をもつアバスチン®という分子標的薬が膠芽腫の治療成績を向上させたという報告をもとに、日本では2013年に保険認可されました。初発・再発を問わず、悪性グリオーマに対して用いることができます。2週間に一度の注射を外来にて行い(初回は入院)、所要時間は30分〜1時間です。副作用として高血圧、頭痛、下痢、口内炎、出血(脳出血を含む)、血栓塞栓症(脳梗塞・心筋梗塞・深部静脈血栓症を含む)、消化管穿孔、創傷治癒遅延などがあります。
東大病院においては、保険適応以前にも治験審査委員会に認可された自主臨床試験という形で治療を行ってきた経緯があり、最も予後が悪いといわれる膠芽腫の再発に対しても、劇的に病変が縮小した症例を経験しています(図17)。
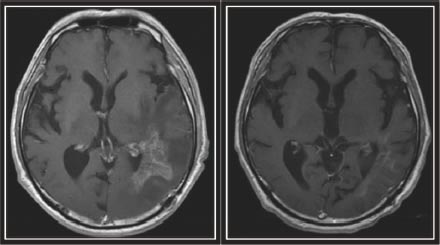
図17:膠芽腫再発に対してアバスチン®による治療をした症例。(左)膠芽腫再発時のMRI画像。(右)アバスチン治療6ヵ月後のMRI画像。造影される腫瘍性病変はほとんど消失しています。
2013年には手術中に使用できる化学療法剤も日本で認可されました。カルムスチン(BCNU)という薬剤が数週間にわたり徐々に放出されるコイン状の徐放剤で、手術で腫瘍を摘出した後の腔に留置してきます(図18)。肉眼的には全て摘出したように見えても、その周囲に腫瘍細胞が浸潤しているのがグリオーマの特徴であるので、摘出腔に化学療法剤を直接置いてくるという方法は非常に合理的です。起こりうる合併症としては、術後の脳浮腫や創部のトラブルなどがあります。
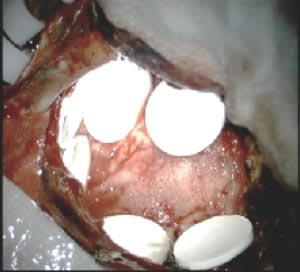
図18:ギリアデル®を留置した術中写真
頭皮に電場パットを貼り、交流電場を持続的に流すことにより腫瘍の分裂を抑制し増殖を阻害する治療法です。2017年に発表された大規模臨床試験の結果が発表され、同治療が膠芽腫患者さんの生存期間を4ヶ月以上延長することが示され、2018年から初発膠芽腫に対して保険適応となりました。腫瘍治療電場療法を行う場合、患者さんは毛髪を剃毛し、1日18時間程度頭皮に電場パットを装着することが推奨されます。また、交流電場を発生される小さな機器を装着時に持ち歩く必要があります。臨床試験で示されたような治療効果が期待できる一方、頭皮のトラブル他、機器装着に伴う負担もあるため、患者さんの希望を尊重しながら当院でも腫瘍治療電場療法を行っています。
前述のように最大限の努力をして治療を行いますが、残念ながら再発することも少なくありません。この場合、症状の進行を少しでも遅らせるように、また初発時の組織診断と若干異なるものに変化している場合がありますので、新たな組織診断のために手術(生検)が再び必要なことがあります。初発時と同じように、綿密な検査と相談ののち治療方針を決定します。可能な場合には再び摘出術を行うことがあります。その後の放射線の追加照射は困難なことがありますが、ガンマナイフなどにより治療できることもあります。化学療法もしばしば薬剤を変更して行っています。
それらの治療のほかに、東大病院では次のような新しい治療法を行っています。これらには研究段階の治療法もあり、効果や副作用などにつきましては診察時に詳しくご説明します。
当院にて施行中の試験治療には以下のようなものがあります。
東京大学脳神経外科では、別記にあるように多くの多施設共同試験に参加しています。
ウイルス療法とは、腫瘍細胞に限定して増えることができる遺伝子組換えウイルスを用いて腫瘍細胞を破壊する治療法です。悪性脳腫瘍に対しては、単純ヘルペスウイルスを用いた臨床試験が欧米ですでに行われています。東大病院においても、2009年11月よりウイルス療法の臨床試験を行ってきましたが、現在は東京大学医科学研究所付属病院で主に行われています。
分子診断、治療感受性評価のために脳神経外科研究室で行われる遺伝子解析(項目3)に加えて治療標的となりうる患者さんの腫瘍特有の遺伝子異常がないか、数百の遺伝子について次世代シークエンサーを用いて同時に調べる検査で、2019年以降保険診療下で行うことができるようになりました。最新のものとしては、2023年より東大オンコパネル検査(Genmine TOP)を用いて検査が可能です。東大オンコパネルは、他の遺伝子パネル検査と比べてより多数の遺伝子をカバーしている点、DNAだけでなくRNAからも融合遺伝子などの治療標的を検出できる点といった強みを有しています。得られた結果はエキスパートパネルと呼ばれる遺伝子解析の専門家の会議で検討され、その結果を基づいて患者さんに返却しております。治療標的となる遺伝子異常が神経膠腫に見つかる頻度は決して高いとは言えませんが、BRAF遺伝子V600E変異に対するダブラフェニヴ等、効果的な分子標的薬治療の提供に繋がる異常が同定できることがあります。これらの結果次第では、患者さんの個々の腫瘍にぴったり合った治療(個別化医療)が可能となることもあります。
疾患・治療に関するご相談につきましては、東京大学医学部附属病院の「脳腫瘍外来」を受診してください。その際、過去におとりになられた画像(MRI・CTなど)や検査結果、現在かかりつけの医師からの紹介状などがありますと、病状の判断に大変役立ちますので、出来る限りお持ちください。一人一人の患者さんをしっかりと診察させていただくため、脳腫瘍外来は完全予約制とさせていただいています。お手数ですが、東京大学医学部附属病院の外来予約センター(03-5800-8630、12:30〜17:00)にお電話いただき、予約をお取りください。
| 責任担当医師 | 脳神経外科 高見 浩数(たかみ ひろかず) Eメール:takamih-nsu@h.u-tokyo.ac.jp |
|---|---|
| 担当医師 | 脳神経外科 野村 昌志(のむら まさし) 脳神経外科 北川 陽介(きたがわ ようすけ) |
| 連絡先 | 東京大学医学部附属病院 〒113-8655 東京都文京区本郷 7-3-1 電話 03-3815-5411(代表) 脳腫瘍外来(毎週月曜日午後、水曜日午後午前、金曜日午後) |
完全予約制です。外来受診につきましては、東京大学医学部附属病院のホームページ(http://www.h.u-tokyo.ac.jp/)をご参照ください。